العلاقة القطرية (العلاقة الزاوية) في الجدول الدوري Diagonal Relationship in Periodic Table
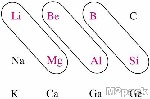
علاقة ضمن الجدول الدوري تظهر جليا في بعض عناصر الدورة الثانية التي تتشابه في صفاتها الكيميائية مع العناصر التي تقع في الدورة الثالثة و لكن بصورة زاوية وهذا التشابه يمكن توضيحه كما يلي :
الليثيوم و المغنيسيوم
1 – كل منهما يشكلان الكلوريدات التي تتميأ ببطء و هي قابلة للذوبان في الإيثانول .
2 – كل منهما يشكلان نيتريدات عديمة اللون او شبه ملونة عن طريق التفاعل المباشر مع النيتروجين عند درجات الحرارة العالية .
3 – كل منهما يحترقان في الهواء لتعطي أكاسيد طبيعية .
4 – كل منهما يشكلان الكربونات التي تتحلل عند التسخين .
البريليوم و الألومنيوم
1 – كل منهما يشكلان أكاسيد مستقرة جدا مع أشكال متعددة لها .
2 – كل منهما يشكلان النيتريدات البلورية التي تتميأ في الماء .
3 – كل منهما تعطي الهيدروكسيدات الأمفوتيرية حيث عند تذويبها في زيادة من الهيدروكسيد تعطي أيونات البريلات −Be(OH)4]2] و أيونات الألومينات [Al(OH)4] .
4 – كل منهما يشكلان مركبات هاليدية تساهمية و مركبات ألكيلية تساهمية و التي تظهر التركيب الجسري .
5 – كل من الفلزين يذوبان في القلويات .
البورون و السيليكون
1- كل منهما يظهران صفات أشباه الموصلات .
2 – كل منهما يشكلان هيدريدات غير مستقرة في الهواء الجوي و كلوريدات تتميأ في الهواء الجوي .
3 – كل منهما يشكلان أكاسيد حمضية ذات تركيبات بلورية تساهمية ، حيث تشكل مع العديد من الأكاسيد الأخرى انواع عديدة من الزجاج .
إن سبب هذه العلاقة الزاوية هو نتيجة لزيادة حجم الذرة من أعلى لأسفل في المجموعة و نقصان حجم الذرة من اليسار إلى اليمين في الدورة و كذلك نقصان الكهرسلبية من أعلى لأسفل في المجموعة و زيادة الكهرسلبية من اليسار إلى اليمين في الدورة .



