الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي
للبشر علاقة حميمة بالكهرباء، وتظهر بشكل واسع الانتشار في الطاقة المستخدمة في كافة شؤون الحياة المختلفة، وهي تنتج عن حركة الجسيمات المشحونة مثل الإلكترونات، ومعظم المعادن بها إلكترونات يمكنها أن تنفصل عن ذراتها وتلتف حولها، وتسمى هذه بالإلكترونات الحرة؛ إذ تعمل الإلكترونات الحرة على تسهيل تدفق الكهرباء عبر هذه المواد التي تعرف باسم الموصلات الكهربائية، حيث تنقل الإلكترونات المتحركة الطاقة الكهربائية من نقطة إلى أخرى، ويتم استخدام طاقة الإلكترونات لإنشاء الحرارة التي تخلق بدورها الضوء، وفي المحرك الكهربائي تخلق الطاقة في الإلكترونات مجالًا مغناطيسيًا، وسيتحدث هذا المقال عن الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي.[١]
الخلية الجلفانية
لا جدال في أهمية الخلايا والبطاريات في كل شؤون الحياة، ومن بين تلك الخلايا: خلية التحليل الكهربائي والخلية الجلفانية، والخلية الجلفانية هي نوع من الخلايا الكهروكيميائية يتم استخدامها لتزويد التيار الكهربائي عن طريق نقل الإلكترونات من خلال تفاعلات الأكسدة والاختزال، وتعمل الخلية الجلفانية كجهاز تحدث فيه تفاعلات الأكسدة والاختزال المتزامنة، وتستخدم هذه التفاعلات لتحويل الطاقة الكيميائية إلى طاقة كهربائية، والتي يمكن استخدامها لأي غرض تجاري، وعمل الخلية الجلفانية بسيط للغاية، وهو ينطوي على تفاعل كيميائي يجعل الطاقة الكهربائية متاحة كنتيجة نهائية، وهذا يسبب وجود الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي، فأثناء تفاعل الأكسدة والاختزال، تستخدم الخلية الجلفانية في نقل الطاقة بين الإلكترونات لتحويل الطاقة الكيميائية إلى طاقة كهربائية، فللخلية الجلفانية القدرة على فصل تدفق الإلكترونات في عملية الأكسدة والاختزال، مما يتسبب في تفاعل نصف وربط كل منهما بسلك بحيث يمكن تشكيل مسار لتدفق الإلكترونات عبر هذا السلك.[٢]
تفاعلات الخلية الجلفانية
قبل بيان الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي بشكل أدق ينبغي توضيح أنه يمكن عمل الخلية الجلفانية من أي نوعين من المعادن؛ فيمكن أن يشكل هذان المعدنان الأنود والكاثود، حيث تضم الخلية بشكل مثالي قطبين، واحد من هذه الأقطاب، هو الكاثود الذي يجب أن يكون القطب موجب الشحنة، بينما الآخر يكون هو القطب السالب، وكمثال، حين يكون المعدنان المستخدمان في التفاعل الكيميائي هما الزنك والنحاس، وعند حدوث التفاعل الكيميائي، سينتهي الزنك بفقد إلكترونين ليذهب ذلك الفقد إلى النحاس ليصبح النحاس الأولي، وبما أنه سيتم وضع هذين المعدنين في حاويتين منفصلتين وسيتم توصيلهما بسلك موصل، فسيتم حينها تشكيل تيار كهربائي سينقل جميع الإلكترونات من معدن إلى آخر، وفي الوقت نفسه، يتم غمر المعدنين في محلول ملحي، وعلى سبيل المثال كبريتات الزنك وكبريتات النحاس في هذه الحالة، ولا يتم خلط المحلولين معًا مباشرةً ولكن يمكن ضمهما باستخدام جسر أو وسيط، وتكون هذه الوسيلة مسؤولة عن نقل الأيونات، ويساعد هذا الجسر في إكمال الدائرة لحمل الشحنة الكهربائية، ويتأكد أيضًا من أن المحلول في الحاويات التي تحتوي على المعادن تظل محايدة ولا تختلط مع بعضها البعض، طالما أن الجسر الملحي لا يتداخل مع تفاعل الأكسدة والاختزال.[٢]
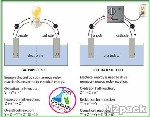
الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي
إن الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي يتضح في الخلية الجلفانية؛ ففي حالة عدم وجود جسر ملح داخل كل حاوية تحتوي على المعادن سيبدأ تفاعل الأكسدة بالطريقة نفسها، لكن في غياب جسر الملح، سينتهي الأمر بشكل مفاجئ إلى حد ما، ولن تتمكن المحاليل موضع التجربة من الحفاظ على حيادها الكهربائي، مما يجعلها تختلف عن خلية التحليل الكهربائي، ويمكن توضيح ذلك كالآتي:[٣]
الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي أن الخلية الجلفانية تحول الطاقة الكيميائية إلى طاقة كهربائية، حيث يكون تفاعل الأكسدة والاختزال تلقائيًا، وهو مسؤول عن إنتاج الطاقة الكهربائية، ويتم في الخلية الجلفانية إنشاء الخليتين النصفيتين في عبوات مختلفة، حيث يتم توصيلهما عبر جسر الملح، ويتم توفير الإلكترونات بواسطة الأنواع التي تتأكسد، حيث تنتقل من الأنود إلى الكاثود في الدائرة الخارجية، حيث يكون الأنود هو القطب السالب والكاثود هو القطب الموجب، والأنود هو موضع الأكسدة، بينما الكاثود هو موضع الاختزال.
مما يحدث الفرق بين الخلية الجلفانية وخلية التحليل الكهربائي أيضًا أن خلية التحليل الكهربائي تقوم بتحويل الطاقة الكهربائية إلى طاقة كيميائية، وتختلف خلية التحليل الكهربائي عن الخلية الجلفانية، في كون خلية التحليل الكهربائي يكون فيها تفاعل الأكسدة والاختزال غير تلقائي، ويجب توفير الطاقة الكهربائية لبدء التفاعل، وفي خلية التحليل الكهربائي يتم وضع كل من الأقطاب في حاوية واحدة في المحلول المنحل بالكهرباء، وهنا تدخل الالكترونات عبر الكاثود وتخرج عبر الآنود الذي يكون موجبًا، بينما الكاثود هو القطب السالب دائمًا في خلية التحليل الكهربائي.



