حمض النيتروز (حمض النتروز) Nitrous acid
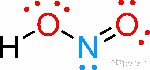
يعرف ايضا باسم حمض النيتريك ثنائي الاكسيد وهو يوجد فقط على شكل محلول (ذو لون أزرق باهت ) و هو حمض ضعيف و سام و صيغته الكيميائية HNO2 ، وزنه الجزيئي 74.01 . في الماء يتغيّر حمض النيتروز بسرعة إلى أكسيد النتريك وحمض النتريك. يكون محاليل نيتريدية مائية مستقرة مع الليثيوم ، الصوديوم ، البوتاسيوم ، الكالسيوم ، السترونشيوم ، الباريوم و الفضة . لا يشكّل أكسيد النيتروز الأملاح مع الآيونات الموجبة عديدة التأكسد الضعيفة مثل الألومنيوم أو البيريليوم . كما انه يكون الأسترات المستقرة مع الكحولات.
و حمض النتروز يوجد على شكل محلول فقط ولا يمكن عزله بشكل نقي و يؤدي تسخينه إلى تفككه وذلك إلى حمض النتريك وأحادي أكسيد النتروجين
{\displaystyle \mathrm {3\ HNO_{2}\ \longrightarrow \ HNO_{3}+2\ NO+H_{2}O} }
كما أن تفاعل حمض النتروز مع المحاليل القلوية يتسبب بتشكيل أملاح النتريت المقابلة لها. فمثلا عند تفاعل حمض النتروز مع محلول هيدروكسيد الصوديوم ينتج نتريت الصوديوم:
{\displaystyle \mathrm {HNO_{2}+NaOH\ \longrightarrow \ NaNO_{2}+H_{2}O} }
عادة ما يتم تحضير حمض النيتروز عن طريق تحميض المحاليل المائية لنتريت الصوديوم مع حمض معدني مل حمض الهيدروكلوريك او الكبريتيك و عادة ما يتم إجراء التحميض عند درجات حرارة الجليد ، ويتم استهلاك HNO2 الناتج في التوّ (حالا) في موقع العمل فهوغير مستقر ويتحلل بسرعة ، كما يمكن أيضًا إنتاج حمض النيتروز عن طريق إذابة ثالث أكسيد النيتروجين في الماء وفقًا للمعادلة
N2O3 + H2O → 2HNO2



