دالة الحالة State Function
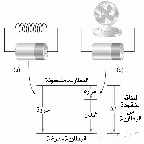
يمكن للماء أن يصل إلى درجة حرارة الغرفة من طريقين مختلفين إما بترك الثلج يذوب لدرجة حرارة الغرفة أو ترك الماء االساخن ليبرد إلى درجة حرارة الغرفة ، و هنا نستطيع القول أن الطاقة الداخلية هي دالة الحالة، فهي تعتمد فقط على الحالة الحالية للنظام و ليس على المسار الذي سلكه النظام للوصول إلى تلك الحالة. و عليه فإن ΔE تعتمد فقط على Einitial و Efinal ، و بصيغة أخرى فإن حالة الدالة تعتمد فقط على حالات المادة الإبتدائية و النهائية و ليس على كيفية استخدام الطاقة الداخلية ، و عليه فإن الحرارة و الشغل ليستا دالة للحالة . فمثلا لو تم توصيل بطارية بمقاومة عالية و تم توصيل بطارية أخرى بنفس القوة بمروحة ، فلاحظ أن كلا البطاريتين تستهلكان الطاقة نفسها ، أي أن قيمة ΔE نفسها لم تتغير ، و لكن في حالة البطارية الأولى يكون استهلاك الطاقة على شكل حرارة ، بينما في الحالة الثانية يكون استهلاك الطاقة على شكل حرارة و شغل.
و الظروف التي تؤثر على الطاقة الداخلية تشمل درجة الحرارة و الضغط و أيضا الكمية الكلية للمادة في النظام لأن الطاقة خاصية توسعية.
و يمكن للتفاعلات الكيميائية أن تمتص أو تحرر طاقة و بالتالي يمكن لهذه التفاعلات أن ينتج عنها شغلا.فمثلا عندما يتفاعل الخارصين مع حمض الهيدوكلوريك عند ضغط ثابت ، فإنه ينتج عن التفاعل غاز الهيدروجين ، و يمكن لهذا الغاز أن يستغل لدفع المكبس مثلا . و يمكن تمثيل التفاعل كما يلي :
Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g)
و يسمى الشغل الناتج عن التفاعل السابق باسم شغل الضغط-الحجم. و عندما يكون الضغط ثابنا فإن الشغل يحسب بالعلاقة التالية :
w = -PΔV
حيث P الضغط و ΔV التغير في حجم النظام ، حيث :
ΔV = Vfinal – Vinitial
فعندما يتمدد الحجم تكون قيمة ΔV موجبة و قيمة w سالبة . فالطاقة تتحرر من النظام على صورة شغل و هذا يدل على أن الشغل مطبق من النظام على الوسط المحيط ، و لكن عندما يضغط الغاز فإن قيمة ΔV تكون سالبة.