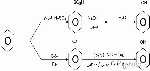
معادلة تفاعل الألمنيوم مع الماء
الألمنيوم هو عنصر كيميائي خفيف الوزن، ذو لون أبيض فضيّ، يصنف داخل مجموعة البورون، وهي المجموعة الرئيسة 13 في الجدول الدوري، ومن المعروف أنّه يتأثر بالحموض والقواعد حتى المخففة منها، ومع ذلك فإنّ موصليته العالية للحرارة والكهرباء وخصائصه الأخرى جعلته مهمًا في العديد من الصناعات، حيث يعد الألمنيوم أكثر المعادن وفرةً في القشرة الأرضية وأكثرها استخدامًا بعد الحديد، ولكن بسبب نشاطه الكيميائي فإنّه لا يوجد في صورته المعدنية النقية ولكن في مركبات موجودة داخل معظم أنواع الصخور فهو يتفاعل مع العديد من المركبات والعناصر كالماء وغيره، وسيذكر هذا المقال معادلة تفاعل الألمنيوم مع الماء بشيء من التفصيل.[١]
معادلة تفاعل الألمنيوم مع الماء
للوهلة الأولى قد يظهر الألمنيوم كمعدن لا يتفاعل مع الماء، إذ أنّ الطبقة الخارجية له تتفاعل مع الماء لتشكل طبقة عازلة من أكسيد الألمنيوم Al2O3، فتمنع وصول جزيئات الماء لباقي ذرات المعدن وتوقف عملية الأكسدة، وبهذا فهو شاذّ عن باقي عناصر مجموعة البورون التي تعرف بعدم تفاعلها مع الماء[٢]، ووفقًا لقوانين الديناميكا الحرارية فإنّ معادلة تفاعل الألمنيوم مع الماء هي كالآتي:[٣]
2Al+6H2O → 2Al(OH)3 + 3H2، وهي الصيغة الأكثر ثباتًا من درجة حرارة الغرفة إلى 280 درجة مئوية.
2Al+4H2O → 2AlO(OH)+3H2، وهي الصيغة الأكثر ثباتًا من 280 إلى 480 درجة مئوية.
2Al+H2O → Al2O3 +3H2، وهي الصيغة الأكثر ثباتًا فوق 480 درجة مئوية.
حيث أنّ Al هو الألمنيوم، H2O هو الماء، Al(OH)3 هو هيدروكسيد الألمنيوم، H2 هو غاز الهيدروجين، (AlO(OH هو أكسيد هيدروكسيد الألمنيوم، Al2O3 هو أكسيد الألمنيوم.
وعادةً ما تضاف كميات قليلة من معدن الألمنيوم إلى بعض المعادن كالبرونز والمغنيسيوم لتحسين خصائصها، كما أنّه يستخدم على نطاق واسع في صناعة الطائرات ومواد البناء وفي الأدوات المنزلية؛ كأواني الطهي والمكيفات، ويدخل أيضًا في صناعة الموصلات الكهربائية وأجهزة المعالجة الكيميائية، أمّا هيدروكسيد الألمنيوم الناتج من تفاعل الألمنيوم مع الماء والظاهر في معادلة تفاعل الألمنيوم مع الماء، فيدخل في صناعة الأقمشة المقاومة للماء وتصنيع أملاح الألمنيوم [١]، والمساعدة في تحسين اللقاحات المناعية[٤]، أمّا أكسيد الألمنيوم فهو عازل كهربائي ذو موصلية حرارية عالية يستخدم في تصنيع السيراميك الذي يستخدم كعازل في صناعة الإلكترونيات. [٥]
تعريف الماء في الكيمياء
الماء هو مركب كيميائي يتكون من ذرتين من الهيدروجين وذرة من الأكسجين، وهو ثالث أكثر المركبات وفرة في الكون بعد غاز الهيدروجين وأول أكسيد الكربون، ترتبط ذرات الأكسجين والهيدروجين في الماء مع بعضها بروابط تساهمية قطبية، أما جزيئات الماء فترتبط مع بعضها البعض بروابط هيدروجينية، وهذه الروابط تمنح الماء توترًا سطحيًا عاليًا مما يسمح لبعض أنواع الحشرات بالمشي عليه، ويعتبر الماء النقي أيضًا عازلًا كهربائيًا، ولكن عادةً ما يحتوي الماء على أيونات ملحية أو قد يتعرض للتأيّن الذاتي مما يزيد من الموصلية الكهربائية للماء، ومن الخصائص الأخرى للماء أنّه يعمل كحمض أو كقاعدة حسب المواد الأخرى التي يتفاعل معها. [٦]