تاريخ الذرة- النظريات والنماذج
تتّكون كلّ المواد من ذرّات. هذا شيء مفروغ منه، وهي واحدة من الأشياء التّي تعلّمناها في بداية الدراسة الثانوية أو دروس الكيمياء في المدارس الثانوية. وعلى الرغم من هذا، أفكارنا حول ماهيّة الذرة هي غريبة بشكل مفاجئ: ما زال العلماء،منذ أقل من مائة سنة، يناقشون ما بدا بالضّبط مثل الذّرة، وكيف تغيرت مع مرور الوقت. لنتعرف سويّة على تاريخ الذرّة …
علينا أن نعود في الزمن إلى زمن اليونان القديمة كي نجد جذورها. فكلمة “ذرّة” تأتي في الواقع من اليونانية القديمة وتترجم تقريباً بأنها “غير قابلة للتجزئة”. والنظرية اليونانية القديمة كان لها الفضل إلى العديد من العلماء، ولكن غالباً ما تعزى إلى ديموقريطس (460-370 قبل الميلاد) ومعلّمه ليوكيبوس. رغم أنّ أفكارهم حول الذرّات كانت بدائية مقارنة مع مفاهيمنا اليوم، فإنّهم وضعوا فكرة أنّ كل شيء مصنوع من الذرّات، وغير مرئية ومجالات قابلة للتجزئة من المادة بأشكال وأعداد غير متناهية.
تصوّر هؤلاء العلماء الذرّات بتنوّعها في شكلها اعتماداً على نوع الذرّة. تصورّوا ذرات الحديد على أنّها عقاف (مثل الشوكة) مجتمعة مع بعضها، موضّحاً لماذا كان الحديد مادّة صلبة في درجة حرارة الغرفة. كانت ذرات الماء سلسة وزلقة، موضحاً لماذا كان الماء السائل في درجة حرارة الغرفة، ويمكن سكبه. على الرغم من أننا نعرف الآن أنّ هذا ليس هو الحال، أفكارهم وضعت الأسس لنماذج ذرّية في المستقبل.
كان عليهم الانتظار طويلاً قبل بناء هذه الأسس عليها. ولم تكن حتّى قام عام 1803 الكيميائي الإنجليزي جون دالتون بوضع تعريف علميّ أكثر للذرّة. ولفت انتباهه أفكار الإغريق في وصف ذرّات صغيرة، الكرات الثاّبتة التي تكون غير قابلة للتجزئة، وأنّ ذرات عنصر معّين متطابقة مع بعضها البعض. النقطة الأخيرة هي التي إلى حد كبير لا تزال صحيحة، مع استثناء ملحوظ مع نظائر العناصر المختلفة، والتي تختلف في عدد النيوترونات. ومع ذلك، منذ عدم اكتشاف النيوترون حتى عام 1932، ربما نستطيع أن نغفر لدالتون هذا السهو . وقيل أنّه خطرت له نظريات حول كيفية الجمع بين الذرات لتكوين المركبات، خطرت أيضاً له أول مجموعة من الرموز الكيميائية للعناصر المعروفة.
كان المخطّط التفصيلي لنظرية دالتون الذريّة مجرّد البداية، ومع ذلك لم تخبرنا كثيراً عن طبيعة الذرّات نفسها. وما تبع ذلك فإنّه شيء آخر، حيث علمنا عن الذرّات قد دخل في مرحلة خمود، وكانت هناك بعض المحاولات لتحديد ما الذرّات مثل ما اقترحه اللورد كلفن، حيث اقترح أنّ للذرّات بنية تشبه الدوّامة. وبقي التقّدم خامداً حتّى مطلع القرن ال 20 حيث استطاعوا التقدّم في توضيح التركيب الذرّي.
كانت الانطلاقة الأولى في أواخر 1800 عندما اكتشف الفيزيائي الإنجليزي جوزيف جون أنّ الذرّة ليست قابلة للتجزئة كما ادّعى سابقاً! حيث أجرى عدّة اختبارات باستخدام أشعة سلبية منتجة في أنابيب التصريف، ووجد أنّ الأشعّة قد انجذبت للوحات معدنية إيجابية الشحنة ولكنّها صُّدت من قبل لوحات سلبية الشحنة. ومن هنا استخلص أنّ الأشعة يجب أن تكون مشحونة سلباً.
وعن طريق قياس الشّحنة على الجزيئات في الأشعّة، استطاع الاستنتاج أنّهم كانوا أخف من الهيدروجين بألفي مرّة، وبتغيير المعدن والقطب السالب استطاع أن يقول أنّ هذه الجزيئات كانت موجودة في الكثير من الذرّات. وقد اكتشف الإلكترون (على الرغم من أنه أشار إليه على أنّه “كريّة”) وأظهر أنّ الجزيئات غير قابلة للتجزئة، ولكنهّا مكوّنة من مكوّنات أصغر، وهذا ما أتاح له الفوز بجائزة نوبل عام 1906.
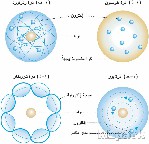
وفي عام 1904 طرح نموذجه للذرّة بناء على استنتاجاته وأطلق عليه اسم “نموذج حلوى الخوخ” (ولكن ليس من قبل طومسون نفسه)، حيث تخيّل الذرّة كمجال من الشحنات الموجبة، مع إلكترونات تنتشر في جميع الأنحاء مثل الخوخ في الحلوى. وكان العلماء قد بدأوا التشارك في دراسة داخل الذرّة، ولكن نموذج طومسون لم يبق لفترة طويلة – وكان واحداً من طلابه من قدّم أدلة وخصّص ذلك للتاريخ.
كان إرنست رذرفورد وهو فيزيائي من نيوزيلندا درس في جامعة كامبردج تحت قيادة طومسون. وكان عمله في وقت لاحق في جامعة مانشستر الذي من شأنه وفّر مزيداً من الإيضاحات عن الدواخل في الذّرة. وجاء هذا العمل بعد أن كان قد حصل بالفعل على جائزة نوبل في عام 1908 لأبحاثه في الكيمياء من المواد المشّعة.
وضع رذرفورد تجربة لتحقيق التركيب الذرّي الذي تشارِك إطلاق جسيمات ألفا موجبة الشحنة في ورقة رقيقة من رقائق الذهب. كانت جسيمات ألفا صغيرة جداً لدرجة أنهّا يمكن أن تمر من خلال رقائق الذهب، وفقاً لنموذج طومسون الذي أظهر شحنة موجبة تنتشر على الذرّة بأكملها، وينبغي أن تفعل ذلك مع قليل أو دون أي انحراف. من خلال تنفيذ هذه التجربة، وقال إنّه يأمل أن تكون قادرة على تأكيد نموذج طومسون، ولكن انتهى به المطاف بقيامها بالعكس تماماً.
مرّت الكثير من الجسيمات، أثناء التجربة، من خلال الرقاقة مع انحراف قليل أو معدوم. ومع ذلك، عدد قليل جداً من الجزيئات قد انحرفت عن مساراتها الأصلية بزوايا كبيرة جداً. وكان هذا غير متوقع تماماً. كما لاحظ رذرفورد نفسه، “وكان تقريباً لا يصدِّق كما لو كنت قد أطلقت قذيفة 15 بوصة في قطعة من المناديل الورقية وعادت وضربتك”. وكان التفسير الوحيد الممكن أنّ الشحنة الموجبة لم تنتشر في جميع أنحاء الذّرة، ولكن تتركز في مركز صغير، كثيف أي النواة. وكان معظم ما تبقى من الذّرة ببساطة مساحة فارغة.
إنّ اكتشاف رذرفورد للنواة يعني أنّ النموذج الذرّي في حاجة إلى إعادة نظر. و قام باقتراح نموذجاً تدور فيه الإلكترونات في نواة موجبة الشحنة. في حين كان هذا التحّسن على نموذج طومسون، إلا أنه لم يوضح ما الذي يبقي الإلكترونات تدور بدلاً من مجرد التصاعد داخل النواة.
دخل نيلز بور. وكان بور الفيزيائي الدنماركي الذي شرع في محاولة لحل المشاكل مع نموذج رذرفورد، حيث أدرك أن الفيزياء الكلاسيكية لا يمكنها أن تفّسر بشكل صحيح ما يجري على المستوى الذري. بدلاً من ذلك، استخدم نظرية الكم في محاولة لشرح ترتيب الإلكترونات. افترض نموذجه وجود مستويات طاقيّة أو قذائف من الإلكترونات. يمكن العثور على الإلكترونات فقط في مستويات طاقيّة محدّدة؛ وبعبارة أخرى، طاقتها قد أثبتت قيمتها ولكنّه لم يستطع تحديد قيمة لها. والإلكترونات يمكن أن تتحّرك بين هذه المستويات الطاقيّة (التي أشار إليها بور على أنّها “حالة مستقرة”)، لكنه اضطر إلى القيام بذلك إما عن طريق امتصاص أو انبعاث الطاقة.
عالج اقتراح بور عن مستويات الطاقة المستقرّة مشكلة الإلكترونات المتصاعدة في النواة إلى حد ما، ولكن ليس تماماً. الأسباب الحقيقية هي أكثر تعقيداً مما كّنا في طريقنا للبحث هنا، لأننا نخوض في عالم معقّد من ميكانيكا الكم. وكما قال بور نفسه: “إذا لم تصدمك ميكانيكا الكم، فإنك حقاً لم تفهمها بعد”. وبعبارة أخرى فإنّك سوف تحصل على شكل غريب.
لم يستطع نموذج بور أن يحل جميع مشاكل نموذج الذرّة، فنموذجه يعمل بشكل جيد لذرّات الهيدروجين، ولكن لا يمكن أن يفسر الملاحظات عن العناصر الأثقل، كما أنّه كسر مبدأ هايزنبرغ لعدم اليقين. واحد من الركائز الأساسية في ميكانيك الكم، والذي ينص على أننا لا نستطيع أن نعرف الموضع الدقيق والقوّة الدافعة للإلكترون. على الرغم من كل هذا، لا يزال نموذج بور على الأرجح النموذج الذي يعرفه أكثر الناس، لأنه في كثير من الأحيان قد عرفناه في المدرسة الثانوية أو دورات الكيمياء في المدرسة. ولا يزال لديه استخداماته أيضاً؛ حيث إنّه مفيد جداً لشرح الروابط الكيميائية وتفاعل المجموعات من العناصر على مستوى بسيط.
على أيّة حال، لا يزال النموذج المطلوب بحاجة إلى تنقية. في هذه المرحلة، حاول كثير من العلماء تطوير نموذج الكم للذرّة. كان إروين شرودنغر، الفيزيائي النمساوي، الزعيم من بين هؤلاء، هذا الشخص الذي ربما كنت قد سمعت به على أنّه “الرجل مع القط والمربع”. اقترح شرودنغر في عام 1926 أنه بدلاً من تحرك الإلكترونات في مدارات ثابتة أو قذائف، فإنّها هذه الإلكترونات تتحرك كموجات. هذا يبدو غريباً بعض الشيء، ولكن ربما تتذكّر أنّ الضوء يمكن أن يتصرف على حد سواء؛ كموجة وجسيم، وهذت ما يعرف بازدواجية موجة-جسيم. واتضح أنّ الإلكترونات يمكنها فعل ذلك أيضاً.
حلَّ شرودنغر سلسلة من المعادلات الرياضية لأجل التوّصل إلى نموذج لتوزيع الإلكترونات في الذرة. يُظْهِر نموذجه النواة محاطة بسحابة كثيفة من الإلكترونات. هذه السحب هي سحب من الاحتمالات، وعلى الرغم من أننّا لا نعرف بالضبط أين هي الإلكترونات، نرجّح أن تكون موجودة في مناطق معينة من الفضاء. ويشار إلى هذه المناطق من الفضاء بالمدارات الإلكترونية.
لم تكن لشرودنغر الكلمة الأخيرة حول الذرّة. ففي عام 1932، اكتشف عالم الفيزياء الإنجليزي جيمس تشادويك (طالب إرنست رذرفورد) وجود النيوترون، مكمّلاً الصورة لدينا حول الجسيمات تحت الذريّة التي تشّكل الّذرة. لا تنتهي القصة هنا. فقد اكتشف علماء الفيزياء أنّ البروتونات والنيوترونات التي تشكل النواة هي نفسها يمكن تقسيمها إلى جسيمات تسمى الكواركات. على أية حال، الذرّة هي مثال عظيم على كيف يمكن لنماذج علمية أن تتغير مع مرور الوقت، ويظهر كيف أنّ أدلة جديدة يمكن أن تؤدي إلى نماذج جديدة.